pH-definition och ekvation i kemi
 Share
Share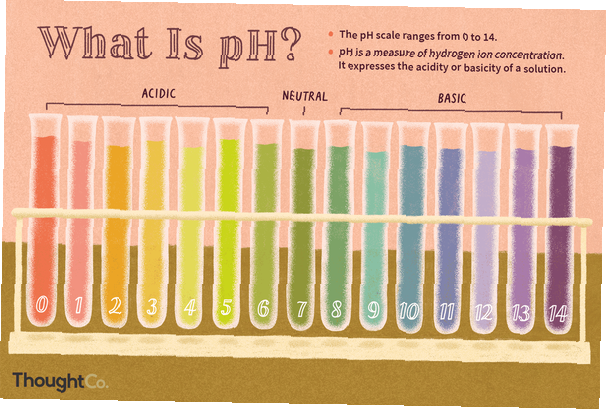
pH är ett mått på vätejonkoncentrationen, ett mått på surhetsgraden eller alkaliniteten i en lösning. PH-skalan sträcker sig vanligtvis från 0 till 14. Vattenlösningar vid 25 ° C med ett pH mindre än 7 är sura, medan de med ett pH som är högre än 7 är basiska eller alkaliska. En pH-nivå på 7,0 vid 25 ° C definieras som "neutral" på grund av koncentrationen av H3O+ motsvarar koncentrationen av OH- i rent vatten. Mycket starka syror kan ha ett negativt pH, medan mycket starka baser kan ha ett pH större än 14.
pH-ekvation
Ekvationen för beräkning av pH föreslogs 1909 av den danska biokemisten Søren Peter Lauritz Sørensen:
pH = -log [H+]
där log är bas-10 logaritmen och [H+] står för vätejonkoncentrationen i enheter mol per liter lösning. Termen "pH" kommer från det tyska ordet "potenz", vilket betyder "kraft", i kombination med H, elementets symbol för väte, så pH är en förkortning för "kraft av väte."
Exempel på pH-värden för vanliga kemikalier
Vi arbetar med många syror (lågt pH) och baser (högt pH) varje dag. Exempel på pH-värden på laboratoriekemikalier och hushållsprodukter inkluderar:
0: saltsyra
2.0: citronsaft
2.2: vinäger
4.0: vin
7.0: rent vatten (neutralt)
7.4: mänskligt blod
13,0: lut
14,0: natriumhydroxid
Inte alla vätskor har ett pH-värde
pH har bara betydelse i en vattenlösning (i vatten). Många kemikalier, inklusive vätskor, har inte pH-värden. Om det inte finns något vatten, finns det inget pH. Till exempel finns det inget pH-värde för vegetabilisk olja, bensin eller ren alkohol.
IUPAC Definition av pH
International Union of Pure and Applied Chemistry (IUPAC) har en något annorlunda pH-skala som är baserad på elektrokemiska mätningar av en standardbuffertlösning. I huvudsak använder definitionen ekvationen:
pH = -log aH+
där enH+ står för väteaktivitet, som är den effektiva koncentrationen av vätejoner i en lösning. Detta kan vara något annorlunda än den verkliga koncentrationen. IUPAC-pH-skalan inkluderar också termodynamiska faktorer, som kan påverka pH.
För de flesta situationer är standard pH-definitionen tillräcklig.
Hur pH mäts
Grova pH-mätningar kan göras med hjälp av lakmuspapper eller en annan typ av pH-papper som är kända för att ändra färger runt ett visst pH-värde. De flesta indikatorer och pH-papper är användbara endast för att berätta om ett ämne är en syra eller en bas eller för att identifiera pH inom ett smalt område. En universalindikator är en blandning av indikatorlösningar avsedda att tillhandahålla en färgförändring över ett pH-område av 2 till 10.
Mer exakta mätningar görs med hjälp av primära standarder för att kalibrera en glaselektrod och pH-mätare. Elektroden fungerar genom att mäta potentialskillnaden mellan en väteelektrod och en standardelektrod. Ett exempel på en standardelektrod är silverklorid.
Användning av pH
pH används i vardagen såväl som inom vetenskap och industri. Det används i matlagning (t.ex. reagera bakpulver och en syra för att få bakverk att stiga), för att designa cocktails, i städare och i konservering av mat. Det är viktigt inom poolunderhåll och vattenrening, jordbruk, medicin, kemi, teknik, oceanografi, biologi och andra vetenskaper.
