Vad är syror och baser?
 Share
Share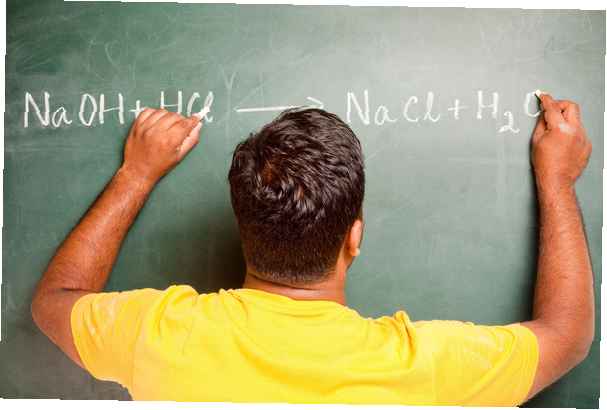
Det finns flera metoder för att definiera syror och baser. Även om dessa definitioner inte motsäger varandra, varierar de i hur inkluderande de är. De vanligaste definitionerna av syror och baser är Arrhenius syror och baser, Brønsted-Lowry syror och baser, och Lewis syror och baser. Antoine Lavoisier, Humphry Davy och Justus Liebig gjorde också observationer angående syror och baser, men formaliserade inte definitioner.
Svante Arrhenius syror och baser
Arrhenius-teorin om syror och baser går tillbaka till 1884 och bygger på sin iakttagelse av att salter, såsom natriumklorid, dissocierar till vad han kallade joner när den placeras i vatten.
- syror producerar H+ joner i vattenlösningar
- baser producerar OH- joner i vattenlösningar
- vatten krävs, så endast möjliggör vattenlösningar
- endast protiska syror är tillåtna; krävs för att producera vätejoner
- endast hydroxidbaser är tillåtna
Johannes Nicolaus Brønsted - Thomas Martin Lowry syror och baser
Brønsted- eller Brønsted-Lowry-teorin beskriver syrabasreaktioner som en syra som frisätter en proton och en bas som accepterar en proton. Även om syredefinitionen är ganska samma som den som föreslås av Arrhenius (en vätejon är en proton), är definitionen av vad som utgör en bas mycket bredare.
- syror är protondonatorer
- baser är protonacceptorer
- vattenlösningar är tillåtna
- baser förutom hydroxider är tillåtna
- endast protiska syror är tillåtna
Gilbert Newton Lewis syror och baser
Lewis-teorin om syror och baser är den minst restriktiva modellen. Det handlar inte alls om protoner utan handlar uteslutande om elektronpar.
- syror är elektronpar-acceptorer
- baser är elektronparparatorer
- minst begränsande av syra-basdefinitionerna
Egenskaper hos syror och baser
Robert Boyle beskrev kvaliteten hos syror och baser 1661. Dessa egenskaper kan användas för att enkelt skilja mellan de två uppsättningarna kemikalier utan att utföra komplicerade tester:
syror
- smaka surt (smaka inte på dem!) - ordet "syra" kommer från latin acere, vilket betyder "sur"
- syror är frätande
- syror byter litmus (ett blått grönsaksfärgämne) från blått till rött
- deras vattenhaltiga (vatten) lösningar leder elektrisk ström (är elektrolyter)
- reagera med baser för att bilda salter och vatten
- utveckla vätgas (H2) vid reaktion med en aktiv metall (såsom alkalimetaller, jordalkalimetaller, zink, aluminium)
Vanliga syror
- citronsyra (från vissa frukter och grönsaker, särskilt citrusfrukter)
- askorbinsyra (vitamin C, från vissa frukter)
- vinäger (5% ättiksyra)
- kolsyra (för kolsyra av läskedrycker)
- mjölksyra (i kärnmjölk)
baser
- smak bitter (smak inte dem!)
- känn dig hal eller tvål (rör inte godtyckligt med dem!)
- baserna ändrar inte färg på lakmus; de kan bli röd (surgjord) lakmus tillbaka till blått
- deras vattenhaltiga (vatten) lösningar leder en elektrisk ström (är elektrolyter)
- reagera med syror för att bilda salter och vatten
Vanliga baser
- detergenter
- tvål
- lut (NaOH)
- hushållsammoniak (vattenhaltig)
Starka och svaga syror och baser
Styrken hos syror och baser beror på deras förmåga att dissociera eller bryta in sina joner i vatten. En stark syra eller stark bas dissocierar fullständigt (t.ex. HCl eller NaOH), medan en svag syra eller svag bas endast delvis dissocieras (t.ex. ättiksyra).
Syredissociationskonstanten och basdissociationskonstanten indikerar den relativa styrkan hos en syra eller bas. Syredissociationskonstanten Ken är jämviktskonstanten för en syrabas-dissociation:
HA + H2O ⇆ A- + H3O+
där HA är syran och A- är den konjugerade basen.
Ken = [A-] [H3O+] / [HA] [H2O]
Detta används för att beräkna pKen, den logaritmiska konstanten:
pken = - logg10 Ken
Ju större pKen värde, desto mindre är dissociationen av syran och desto svagare syran. Starka syror har en pKen på mindre än -2.
