Typer av kemiska reaktioner
 Share
Share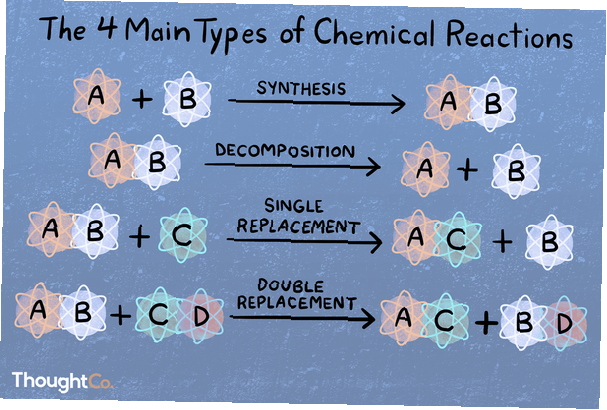
En kemisk reaktion är en process som i allmänhet kännetecknas av en kemisk förändring där utgångsmaterialen (reaktanter) skiljer sig från produkterna. Kemiska reaktioner tenderar att involvera rörelser av elektroner, vilket leder till bildande och brytning av kemiska bindningar. Det finns flera olika typer av kemiska reaktioner och mer än ett sätt att klassificera dem. Här är några vanliga reaktionstyper:
Oxidationsreduktion eller redoxreaktion
I en redoxreaktion förändras atomernas oxidationsantal. Redoxreaktioner kan innebära överföring av elektroner mellan kemiska arter.
Reaktionen som inträffar när I2 reduceras till I- och S2O32- (tiosulfatanjon) oxideras till S4O62- ger ett exempel på en redoxreaktion:
2 S2O32-(aq) + I2(aq) → S4O62-(aq) + 2 I-(Aq)
Direktkombination eller syntesreaktion
I en syntesreaktion kombineras två eller flera kemiska arter för att bilda en mer komplex produkt.
A + B → AB
Kombinationen av järn och svavel för att bilda järn (II) sulfid är ett exempel på en syntesreaktion:
8 Fe + S8 → 8 FeS
Kemisk sönderdelnings- eller analysreaktion
Vid en sönderdelningsreaktion bryts en förening i mindre kemiska arter.
AB → A + B
Elektrolysen av vatten till syre och vätgas är ett exempel på en sönderdelningsreaktion:
2 H2O → 2 H2 + O2
Enstaka förskjutnings- eller substitutionsreaktion
En substitutions- eller enstaka förskjutningsreaktion kännetecknas av att ett element förskjuts från en förening av ett annat element.
A + BC → AC + B
Ett exempel på en substitutionsreaktion uppstår när zink kombineras med saltsyra. Zink ersätter väte:
Zn + 2 HCl → ZnCl2 + H2
Metathesis eller Double Deplacement Reaction
Vid en dubbel förträngning eller metatisk reaktion byter två föreningar bindningar eller joner för att bilda olika föreningar.
AB + CD → AD + CB
Ett exempel på en dubbel förträngningsreaktion inträffar mellan natriumklorid och silvernitrat för att bilda natriumnitrat och silverklorid.
NaCl (aq) + AgNO3(aq) → NaNO3(aq) + AgCl (s)
Syrabasreaktion
En syrabasreaktion är en typ av dubbelförskjutningsreaktion som inträffar mellan en syra och en bas. H+ jon i syran reagerar med OH- jon i basen för att bilda vatten och ett joniskt salt:
HA + BOH → H2O + BA
Reaktionen mellan bromvätesyra (HBr) och natriumhydroxid är ett exempel på en syrabasreaktion:
HBr + NaOH → NaBr + H2O
Förbränning
En förbränningsreaktion är en typ av redoxreaktion där ett brännbart material kombineras med ett oxidationsmedel för att bilda oxiderade produkter och generera värme (exoterm reaktion). Vanligtvis kombineras syre i en förbränningsreaktion med en annan förening för att bilda koldioxid och vatten. Ett exempel på en förbränningsreaktion är förbränning av naftalen:
C10H8 + 12 O2 → 10 CO2 + 4 H2O
isomerisering
I en isomeriseringsreaktion förändras strukturförfarandet för en förening men dess netto-atomkomposition förblir densamma.
Hydrolysreaktion
En hydrolysreaktion involverar vatten. Den allmänna formen för en hydrolysreaktion är:
X-(aq) + H2O (l) ↔ HX (aq) + OH-(Aq)
De viktigaste reaktionstyperna
Det finns hundratals eller till och med tusentals typer av kemiska reaktioner! Om du blir ombedd att ange huvudsakliga 4, 5 eller 6 typer av kemiska reaktioner, är detta hur de kategoriseras. De viktigaste fyra typerna av reaktioner är direkt kombination, analysreaktion, enkel förflyttning och dubbel förträngning. Om du frågas om de fem huvudtyperna av reaktioner är det dessa fyra och sedan antingen syrabas eller redox (beroende på vem du frågar). Tänk på att en specifik kemisk reaktion kan falla i mer än en kategori.
