Osmosdefinition i kemi
 Share
Share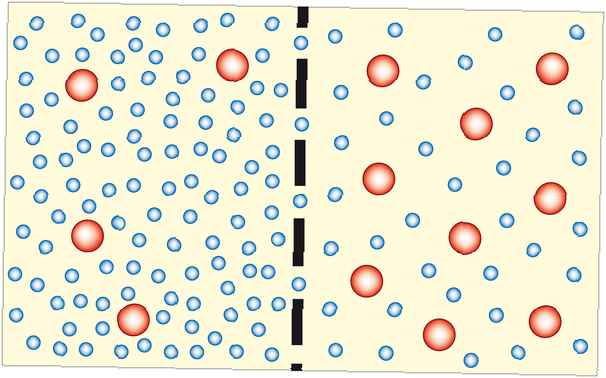
Två viktiga masstransportprocesser inom kemi och biologi är diffusion och osmos.
Osmos Definition
Osmos är processen där lösningsmedelsmolekyler rör sig genom ett semipermeabelt membran från en utspädd lösning till en mer koncentrerad lösning (som blir mer utspädd). I de flesta fall är lösningsmedlet vatten. Lösningsmedlet kan emellertid vara en annan vätska eller till och med en gas. Osmos kan göras för att göra arbete.
Historia
Fenomenet osmos var först dokument 1748 av Jean-Antoine Nollet. Begreppet "osmos" myntades av den franska läkaren René Joachim Henri Dutrochet, som härledde det från termerna "endosmose" och "exosmose."
Hur Osmos fungerar
Osmos verkar för att utjämna koncentrationen på båda sidor av ett membran. Eftersom de lösta partiklarna inte kan korsa membranet, är det vattnet (eller annat lösningsmedel) som behöver röra sig. Ju närmare systemet kommer i jämvikt, desto stabilare blir det, så osmos är termodynamiskt fördelaktig.
Exempel på osmos
Ett bra exempel på osmos ses när röda blodkroppar placeras i färskt vatten. Cellmembranet i de röda blodkropparna är ett semipermeabelt membran. Koncentrationen av joner och andra lösta molekyler är högre inuti cellen än utanför den, så vatten rör sig in i cellen via osmos. Detta får cellerna att svälla. Eftersom koncentrationen inte kan nå jämvikt modereras mängden vatten som kan röra sig in i cellen av cellmembranets tryck som verkar på cellens innehåll. Ofta tar cellen in mer vatten än membranet kan bibehålla, vilket gör att cellen spricker.
En besläktad term är osmotiskt tryck. Osmotiskt tryck är det yttre trycket som skulle behöva appliceras så att det inte skulle finnas någon nettolösning av lösningsmedel över ett membran.
