Åskådare Ion Definition och exempel
 Share
Share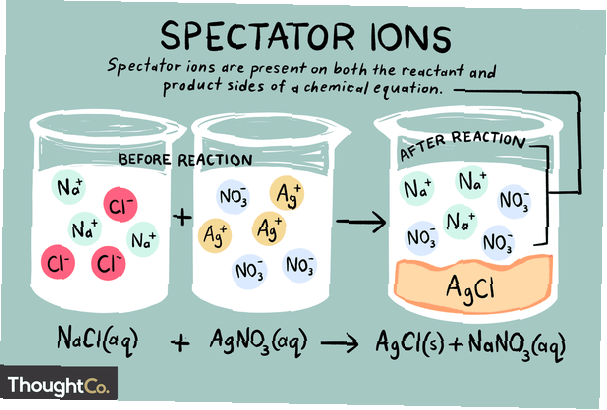
Joner är atomer eller molekyler som har en elektrisk nettoladdning. Det finns olika typer av joner, inklusive katjoner, anjoner och åskådarjoner. En åskådarjon är en som finns i samma form på både reaktant- och produktsidorna i en kemisk reaktion.
Åskådare Ion Definition
Åskådarjoner kan vara antingen katjoner (positivt laddade joner) eller anjoner (negativt laddade joner). Jonen är oförändrad på båda sidor av en kemisk ekvation och påverkar inte jämvikten. När man skriver en jon nettoekvation ignoreras åskådarjoner som finns i den ursprungliga ekvationen. Således total jonreaktion skiljer sig från netto kemisk reaktion.
Exempel på åskådarejon
Överväg reaktionen mellan natriumklorid (NaCl) och kopparsulfat (CuSO)4) i vattenlösning.
2 NaCl (aq) + CuSO4 (aq) → 2 Na+ (aq) + SO42- (aq) + CuCl2 (S)
Den joniska formen av denna reaktion är: 2 Na+ (aq) + 2 Cl- (aq) + Cu2+ (aq) + SO42- (aq) → 2 Na+ (aq) + SO42- (aq) + CuCl2 (S)
Natriumjoner och sulfatjon är åskådarjoner i denna reaktion. De verkar oförändrade både i produktens och reaktantsidan av ekvationen. Dessa joner bara "spekte" (klocka) medan de andra jonerna bildar kopparklorid. Åskådarjonerna avbryts ur en reaktion när man skriver den joniska nettoekvationen, så den nettonjoniska ekvationen för detta exempel skulle vara:
2 Cl- (aq) + Cu2+ (aq) → CuCl2 (S)
Även om åskådarjoner ignoreras i nätreaktionen påverkar de Debye-längden.
Tabell över vanliga åskådarejoner
Dessa joner är åskådarjoner eftersom de inte reagerar med vatten, så när lösliga föreningar av dessa joner upplöses i vatten påverkar de inte direkt pH och kan ignoreras. Medan du kan konsultera ett bord, är det värt att memorera de vanliga åskådarjonerna eftersom att känna till dem gör det lättare att identifiera starka syror, starka baser och neutrala salter i en kemisk reaktion. Det enklaste sättet att lära sig dem är i grupper om tre eller trios joner som finns tillsammans på elementets periodiska tabell.
